Debreceni Egyetem Orvos- és Egészségtudományi Centrum, Orvostudományi Kar, II. Belgyógyászati Klinika, Hematológiai Tanszék1 és I. Belgyógyászati Klinika, Anyagcsere Tanszék2
A B28ASP (INSULIN B28) ÉS A LISPRO (LISPRO) ANALÓG INZULINOK IN VITRO THROMBOCYTA AGGREGÁCIÓS ÉS FIBRINOLYTICUS HATÁSAI
Udvardy Miklós,1 Rejtő László,1 Reményi Gyula,1 Káplár Miklós2
Összefoglalás
Az új, gyors hatású, élettani koncentrációtartományban monomer formában (hígítva, in vitro is) oldott, a cukorbetegség korszerű ellátásában ismert módon nagy jelentőségű analóg inzulin készítmények megjelenésével lehetségessé vált az inzulin direkt, in vitro vérlemezke-működést és fibrinolysist befolyásoló hatásainak vizsgálata és jobb megismerése. A jelen felmérés azt igazolja, hogy egyik analóg inzulinnak sincs számottevő thrombocyta aggregációt gátló tulajdonsága. S bár a hyperinsulinaemia a klinikai tapasztalat szerint általában csökkent fibrinolysissel jár, s ennek az érszövődmények kialakulása szempontjából is jelentőség tulajdonítható, az analóg inzulinokkal in vitro nyert adataink mégis arra utalnak, hogy az fokozhatja a fibrinolysis enzimatikus kulcslépésének, a plazminogén plazminná történő átalakulásának a sebességét. A B28Asp analóg profibrinolyticus tulajdonságai lényegesen erősebbnek bizonyultak az általunk alkalmazott rendszerben, amely tulajdonság egyben az alvadékoldás gyorsulását is eredményezte. A két analóg profibrinolyticus tulajdonságai közötti kvantitatív különbséget valószínűleg a kémiai szerkezet finom eltérései magyarázhatják. Logikus feltételezés, hogy a fibrinolysis gyorsítása az analóg inzulinos kezelés előnyös tulajdonsága lehet.
Kulcsszavak: humán inzulin, analóg inzulinok, aspart inzulin (B28), Lispro inzulin, plazmingeneráció, thrombocyta aggregáció
In vitro platelet aggregatory and fibrinolytic properties of B28Asp (Insulin B28) and Lispro (Lispro) insulin analogues
Summary
The new ultrafast acting analogue insulins have crucial importance in diabetes therapy, and in addition their monomeric property provide better and new possibilities to study and understand the direct in vitro haemostatic actions of insulin than before. In our settings there were no in vitro platelet antiaggregatory effect with the use of insulin Lispro and insulin B28Asp. Although hyperinsulinaemia seems to be clearly associated with reduced fibrinolysis and vascular complications, the in vitro data gained in this series of experiments revealed acceleration of tPA induced plasmin generation with Lispro and B28Asp insulin. Accelerated clot-lysis was also documented in the presence of aspart insulin. B28Asp insulin exerted stronger profibrinolytic activity in vitro than Lispro insulin, which is probably due to the chemical and conformational differences between the two compounds. The profibrinolytic potential of analogue insulin therapy seems to be theoretically advantageous.
Keywords: human insulin, insulin analogues, insulin aspart (B28), insulin Lispro, plasmin generation, platelet aggregation
A cukorbetegség érszövődményeinek patomechanizmusa, kiváltása, lefolyása szempontjából a haemostasis zavarának nagy jelentőség tulajdonítható.1 A haemostasis zavara alapvetően a glukometabolikus és peroxidatív tényezők eredménye, az akut és a krónikus hyperglykaemia szerepe e szempontokból egyaránt meghatározó jelentőségű.1,2,3
Az 1-es típusú betegségben az endogén inzulinprodukció és -szekréció jelentős csökkenése, közel teljes hiánya alakul ki.1 A 2-es típusban jellemző a viszonylag megtartott (vagy a korai fázisban fokozott) inzulinszekréció. Az inzulin hiánya és relatív túlsúlya egyaránt jelentős tényező az endothelium, az érfal állapota, anyagcseréjének szabályozása, de a haemostasis működése szempontjából is.2,3
Az inzulin hiánya főképp az 1-es típusú diabetesben a thrombocyta-hiperfunkció kialakításának egyik additív tényezője lehet.4 Több adat utal ugyanis arra, hogy az inzulinpótlás javítja a thrombocytaműködés gátlásához szükséges prosztaglandin-érzékenységet, fokozza a thrombocytaműködést gátló EDRF-NO produkcióját.5,6 A thrombocytákon vannak, vélhetően tökéletlen (nem dimer szerkezetű), inzulinkötő helyek (receptorszerű struktúrák), s az inzulin kötődése a thrombocytákhoz kémiailag is igazolható.7,8 Az inzulin rendelkezik direkt ciklikus-GMP-moduláló hatással is, ami azt eredményezheti, hogy kisebb (de ez sem alacsony koncentráció) mennyisége aggregáció-gátló, igen nagy mennyisége esetleg akár aggregáció-fokozó hatású is lehet.9
A thrombocyták inzulinreceptorainak diabetesben bekövetkező változásairól elsőként munkacsoportunk számolt be (125monojód-inzulin, sertés), s leírtuk később a diabeteszesek thrombocytáinak inzulinra (Actrapid sertés és humán) adott gátlásának nem teljes értékű voltát is.7,8
A legnagyobb számú, a direkt inzulin-thrombocyta kölcsönhatást elemző vizsgálatot Trovati és mtsai végezték.4,9 Általában 60-150
mE/ml mellett észleltek aggregációgátlást.Trovati és saját munkacsoportunk is Actrapid inzulint használt in vitro vizsgálataihoz.7,9 Valószínűleg éppen ezért általában nem sikerült a Trovati-csoport eredményeit reprodukálni, ahány inzulinampulla, annyiféle hatást láttunk (semleges hatás, máskor aggregáció-gátlás, olykor -fokozás). Fenntartással fogadható valamennyi korábbi vizsgálat eredménye, hiszen a semleges vizes oldatban levő inzulin vélhetően polimerként volt jelen a vizsgálati rendszerekben.
A hyperinsulinaemia, s a hyperproinsulinaemia a fibrinolysis csökkenését idézi elő obesitasban, metabolikus szindrómában és 2-es típusú diabetes korai eseteiben.10 A fibrinolysis zavarának fő okaként a két hormon PAI-1-szintézist fokozó hatását tartják számon, s a PAI-1 a fibrinolysis fontos élettani inhibitora.1,10
Érdekes módon azonban a fibrinolysis enzimatikus kulcslépésével, azaz a plazminogén plazminná átalakulásával (ún. plazmingeneráció) diabetesben nem sokat foglalkoznak a publikációk. A szerzőknek nincs tudomása olyan közlésről, amely az inzulinnak a plazmingenerációra gyakorolt hatását közvetlenül vizsgálta volna.
A plazmingeneráció élettani körülmények között a tPA (szöveti plazminogénaktivátor) vagy az urokináz hatására következik be. A tPA-plazminogén kölcsönhatásból csak egészen kevés plazmin keletkezik (ezért nincs az emberben hypofibrinogenaemia), a reakció ugyanis hármas komplexben zajlik le. Ha a plazminogénhez (4-es Kringle domain lizinkötő helyén) fibrin kapcsolódik, úgy a plazminogén konformációja megváltozik és a tPA hatására (a fibrinmentes állapothoz képest) két-ötszörös mennyiségű plazmin képződik.11 Ez adja a tPA alvadékspecifikus természetét. Kiderült, hogy a fibrinen és fragmentumain kívül a lizin, más poliaminok, az arginin, az epszilon-aminokapronsav és számos egyéb molekula is képes a reakció gyorsítására.11,12 Izgalmas kérdés, hogy az inzulin valójában befolyásolja-e ezt a reakciót, s a válasz a monomer analóg birtokában derülhet ki.
Az inzulin in vitro hatásának vizsgálatát nagyban nehezíti az, hogy ismert módon az inzulin csak savas pH mellett oldódik vízben.13 A teljes oldás melletti savas vegyhatás önmagában is thrombocyta aggregációt gátló hatású. A savas pH másfelől a fibrinolysis enzimatikus lépéseinek az in vitro elemzését, azaz a kromogén szubsztrációs mérését technikailag értékelhetetlenné teszi a nagy kloridmennyiség, s az ionerősség megváltozása miatt. Így érthető, hogy a "történeti" vizes inzulinoldatok a thrombocyta aggregáció és a plazmingeneráció vizsgálatára nem voltak alkalmasak.
A semleges fenolos/krezolos közegben oldott vizes inzulinok (pl. Actrapid sertés és humán vagy Humulin R) pedig a 40 és a 100 E/ml-es (ampulla, cartridge) koncentrációkban polimerizálódnak.13,14,15 A monomer inzulin teljes, a dimer inzulin csekély biológiai hatással rendelkezik, míg a nagyobb polimerek lebomlásukig hatástalanok (ill. nem szívódnak fel).14,15 A polimer formában levő inzulinok pedig megtévesztő, álpozitív vagy -negatív eredményt adnak az in vitro thrombocyta aggregációs és az enzimatikus alapú fibrinolyticus vizsgálatokban egyaránt.
Az új, ún. ultragyors hatású inzulinanalógok semleges vizes oldatban másként viselkednek, mert a fiziológiás koncentráció elérésekor monomer inzulinná alakulnak. Az ampullában levő Lispro, ill. B28 (aspart) inzulinok is hexamer állapotúak, de a subcutan adáskor kialakuló, ill. más módon létrehozott mintegy 1000-szeres hígulás/hígítás mellett mindkét inzulin rendkívül gyorsan monomer állapotba alakul át.16 Ez a tulajdonság biztosítja a két, hazánkban már elérhető gyors hatású inzulinanalóg, a Lispro inzulin (HumalogR) és az aspart inzulin (NovoRapidR) gyors felszívódását. A Lispro inzulinban a B28-29-as helyen az IGF-1 homológ részével egyező aminosavsorrend-csere van (két locus változik), az aspart inzulinban a B28-as helyen levő lizint cserélik aszparaginra (1 aminosav locus változott). Valószínű, hogy az aspart inzulin harmadlagos térszerkezete közelebb áll a humán inzulinéhoz.13,14,15
A jelen felmérés célja az volt, hogy a kereskedelmi forgalomban is megjelent, gyors hatású, élettani koncentrációkban monomer analóg inzulinokkal adatokat szerezzünk azok olyan in vitro haemostasis-hatásairól, nevezetesen a thrombocyta aggregáció és a fibrinolysis befolyásolásáról, amelyek a diabeteszes angiopathia patomechanizmusa szempontjából is fontos tényezőknek gondolhatók.
Módszerek
1. Thrombocyta aggregáció
Hat egészséges személy és 10 cukorbeteg vérmintáit használtuk. A cukorbetegek közül hété 2-es típusú, háromé 1-es típusú volt (átlagos életkor 43,2 év, nő 6, férfi 4). A cukorbetegek mindegyikének anyagcseréje egyensúlyban volt a vérvételek idején (HBA1c 8,5% alatt), s thrombocytaműködést befolyásoló szert nem szedtek. A diabetes tartama átlagosan 3,8 év volt. A citráttal alvadásgátolt vénás vérből centrifugálással thrombocytadús plazmát készítettünk. Ezt 15 percig, 37 °C fokon, keverés mellett inkubáltuk 5-100
mE/ml inzulinnal vagy az analóg inzulinokkal, ill. pufferrel. Ezt követően standard technikával és dózisokkal ADP, adrenalin, trombin, kollagén, arachidonsav, ristomycin aggregációs vizsgálatot végeztünk thrombocyta-aggregométerben (ChronoLog). Az eredményeket a turbiditásváltozás mértékében fejeztük ki.2. Plazmingeneráció
Nagy tisztaságú glu-plazminogént (Sigma), tPA-t (Sigma), urokinázt (Ukidan, Serono), ill. kromogén szubsztrátként S-2251-et (D-Val-Leu-Lys-paranitroanilin) alkalmaztunk. A reakcióhoz 10-10 mg plazminogént, 0,7 mM S-2251-et, ill. 10 E/ml tPA-t vagy urokinázt használtunk. A plazminogén + tPA vagy urokináz keverékből plazmin keletkezik, mely az S-2251-ről a keletkező plazmin mennyiségével arányosan erős sárga szint adó nitroanilint hasít le. A sárga szint fotométerben (ELISA mikroreader) 120 percen keresztül, 405 nm-en mértük, s kinetikus görbét kapva regisztráltuk. A reakció indítása után egyre több plazmin keletkezik, ez adja a görbe, kinetikusan jól elemezhető, meredeken emelkedő első, lineáris szakaszát. Mintegy 60-120 perc múlva már valamennyi plazminogén plazminná alakul, így a reakciógörbe tetőzik, vízszintessé válik. Az adott kinetikus sajátságok mellett jól használhatók az enzimkinetika standard módszerei: így a Vmax (mOD/min - időegységre eső denzitásváltozás). A keletkező plazmin mennyiségének pontos megítélésére, ill. a mennyiségek statisztikai összehasonlításának megkönnyítésére a görbe alatti területeket is meghatároztuk. A módszerrel kapcsolatos részleteket illetően közleményekre hivatkozunk.12,17 Actrapid humán inzulin, Humulin R és Insulin B28 vagy Lispro 1-120
mE/ml közötti, a gyári ampullából higított koncentrációit alkalmaztuk a rendszereinkben. Valamennyi koncentrációra és stimuláló ágensre 6-6 párhuzamos mérést végeztünk, azok eredményét átlagoltuk.3. In vitro alvadékoldás
Négy egészséges személy citráttal alvadásgátolt plazmájához trombin (1 E/ml, Sigma) + 10 E/ml tPA keveréket adtunk. A trombin a plazmát megalvasztja, majd a tPA 90-120 perc alatt feloldja. Alvadáskor a fényszórás fokozódik, az oldáskor csökken, a reakció 450 nm hullámhossznál mikro-ELISA readerben jól követhető. Az oldási fázis enzimkinetikailag a plazmingenerációnál alkalmazotthoz hasonló módon jellemezhető. A rendszerben vizsgáltuk az analóg inzulinok alvadékoldást befolyásoló hatását 1-120
mE/ml koncentrációban, személyenként 4x2 párhuzamos méréssel. A korrekt mennyiségi elemzés céljából a görbe alatti területeket is meghatároztuk, ill. összevetettük. A módszer részletes leírását illetően korábbi közleményekre hivatkozunk.12,17Az alvadékoldás optikai denzitásváltozáson alapuló elemzését a nagyobb bizonyosság igényével, kiegészítettük D-dimer ELISA (Stago) technikájú méréssel is. Ekkor az alvadékoldási próba során keletkező alvadék felülúszójának ("lizátum") D-dimer-koncentrációját is megmértük, melynek mennyisége az oldódás mértékével egyenesen arányos.
4. Statisztika
ANOVA alapú statisztikai elemzést végeztünk a PRISM számítógépes program segítségével (átlagos érték, szórás, szignifikancia, görbe alatti terület, ill. reakciókinetikai analízis).
Eredmények
1. Thrombocytaaggregáció
Az inzulin B28-as előinkubáció 2 személy esetében okozott az ADP és az adrenalinos, egy esetben az arachidonsavas aggregációban értékelhető gátlást. Hasonlóképp csekély, statisztikailag nem értékelhető különbséget észleltünk a Lispro inzulin alkalmazása esetén. Az Actrapid, ill. a Humulin R inzulinokkal végzett aggregációban a normális kontrollhoz képest számottevő vagy reprodukálható aggregációgátlást, -változást nem lehetett kimutatni.
2. Plazmingeneráció
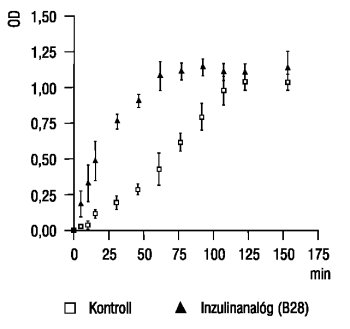
Az inzulin B28 1-10
mE/ml koncentrációban szignifikánsan gyorsította a tPA indukálta plazmingenerációt, ez kb. 2,5-szeresre fokozott ütemet jelent az első 30 percben. Ez a sebesség megfelel a fibrin plazmingenerációt gyorsító hatásának. A gyorsítás statisztikailag erőteljesen szignifikáns, jellemezhető a Vmax (mOD/min) értékkel, a 15-75 perc közötti pontpárok szignifikancájával (p<0,02 - 0,001), de a görbe alatti terület jelentős növekedésével is (p<0,0001). A tPA indukálta, Actrapid és B28 inzulinos rendszerben kapott plazmingenerációs görbéket szemlélteti az 1. és a 2. ábra. A dózis-hatás görbe jellegzetesen "U" alakú, az 1-2 mE/ml alatti és a 100 mE/ml feletti analógkoncentrációk gyorsító hatást nem fejtenek ki. Az urokináz mellett is gyorsító hatást láttunk, de ennek mértéke elmarad a tPA-hoz képest, ill. biológiai jelentősége is kérdésesebb. Az Actrapid és a Humulin R inzulinok mellett a tPA-val és az urokinázzal sem tapasztaltunk változást a plazmingeneráció sebességében. A Lispro inzulinnak az inzulin B28-éhoz hasonló hígításai

1. ábra. A plazmingeneráció kinetikus görbéi inzulin B28 jelenlétében és anélkül. Egyik reprezentatív mérés eredménye, mely jól jelzi, hogy a plazmin képződésének sebessége az inzulin B28 hatására gyorsul. (OD: optikai denzitás)

2. ábra. A plazmingeneráció kinetikus görbéi Actrapid inzulin jelenlétében és anélkül. Látható, hogy az Actrapid inzulin nem befolyásolja a reakció sebességét. (OD: optikai denzitás)
ugyancsak fokozták a plazmingeneráció ütemét, ez a gyorsulás elérte a statisztikusan szignifikáns mértéket, pontosabban annak határát (p=0,0485), a dózis-hatás görbe pedig az inzulin B28-nál látotthoz hasonló. Az inzulin B28 plazmingenerációt serkentő hatása statisztikailag is jelentősebb, mint a Lispro inzuliné (p<0,01).
Az epszilon-aminokapronsavas (0,5 mM) előinkubáció után a plazmingeneráció gyorsul, ezt az inzulin B28 nem gyorsítja tovább. Az inzulin B28 után adott epszilon-aminokapronsavnak sincs további gyorsító hatása. Ez arra utal, hogy a két molekula azonos helyen fejtheti ki hatását a plazminogénre. Ez a hely az epszilonaminokapronsav esetében ismert, a plazminogén 4-es lizinkötő Kringle domainje, azaz a fibrinkötő helye. Így a plazmingenerációt serkentő hatás mértékében és módjában is az élettani fibrin hatásénak felelhet meg.
3. In vitro alvadékoldás
Az in vitro alvadékoldás az inzulin B28 1-30
mE/ml-es koncentrációi mellett gyorsul, az egyik reprezentatív mérési sort szemlélteti a 3. ábra. A görbe alatti terület számítása alapján a különbség statisztikailag szignifikáns (p<0,002). Az alvadékoldás fokozása az egészségesektől és a cukorbetegektől vett vérmintákban egyaránt bekövetkezett. Az urokinázos alvadékoldás gyorsulása nem érte el a 0,05-es szignifikanciaértéket. Az Actrapid és a Humulin R inzulinok mellett az alvadékoldás szeszélyesen változott, az átlag azonos az inzulinmentes rendszerével. Nem észleltünk statisztikailag értékelhető mértékű alvadékoldásbeli változást a Lispro inzulinnal végzett mérések során sem.
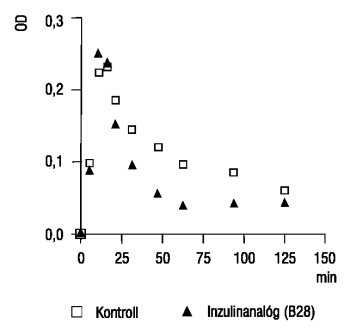
3. ábra. Jellegzetes alvadékoldási görbék. A plazma előbb a trombin hatására megalvad, ez adja a görbék kezdeti, gyors, felszálló szárát, majd az alvadék oldódni kezd, ami az optikai denzitás fokozatos csökkenését okozza (a görbék második, laposodó része). Jól látható, hogy az alvadékoldás az inzulin B28 mellett felgyorsul. (OD: optikai denzitás)

4. ábra. Az alvadékoldás során keletkező D-dimer mennyisége az oldási reakció első 10 percében. Az inzulin B28 mellett a 2-6. percben nagyobb mennyiségű D-dimer képződik, a képződés üteme gyorsabb, mint az Actrapid esetében

1. táblázat. A plazmingenerációs és az alvadékoldási eredmények összegzése a görbe alatti területek számítógépes analízisével
Az in vitro plazmingeneráció és az alvadékoldás számszerű jellemzésére a görbe alatti területek átlagos értékeit foglalja össze az 1. táblázat.
Az aspart inzulin alvadékoldást serkentő hatását az optikai módszer mellett a D-dimer mennyiségének meghatározása segítségével is dokumentáltuk. Az eredményeket a 4. ábra szemlélteti. A D-dimer mennyisége az alvadékoldás során a korai időszakban, a 2-6. perc között a B28 Asp inzulin mellett lényegesen nagyobb (p<0,03).
Megbeszélés
A kereskedelmi forgalmú gyors hatású inzulinanalógokkal (vizes oldatukkal) végzett in vitro thrombocyta aggregációs és plazmingenerációs vizsgálati eredményeink alapján a következő megállapítások tehetők:
A monomer inzulinanalóg, az inzulin B28 a viszonylag érzéketlen in vitro aggregometriás rendszerben nem volt meggyőzően aggregációgátló hatású. Hasonlóképp nem volt érdemleges gátlás a Lispro inzulin mellett sem. Az Actrapid és a Humulin R inzulinok mellett sem észleltünk reprodukálható aggregációgátlást. A módszer finomítható, ill. élőben követéses vizsgálat végezhető. A finomítás módjai a továbbiakban a CD62-P-szelektin expressziójának mérése, a vegyes aggregátum áramlási citometriás vizsgálata, illetve a thrombocyták EDRF-NO-produkciójának mérése lehetnek.18
Az Actrapid, ill. a Humulin R humán inzulinok mellett a plazmingeneráció mértéke (tPA és urokináz mellett egyaránt), ill. az alvadékoldás sebessége nem változott számottevően.
Az inzulin B28 analóg az in vitro, tPA által kiváltott plazmingenerációt a fibrinhez hasonló mértékben és módon, élettanilag jól értelmezhető extrapolációra módot adva gyorsítja. Jellegzetes az "U" alakú dózis-hatás görbe, amely viszonylag kis koncentrációknál, azaz 4-10 mE/ml-nél tetőzik. Az inzulin B28 ennek megfelelően gyorsítja a tPA melletti alvadékoldást is.
A lassult fibrinolysisnek általában komoly szerepet tulajdonítanak a diabeteszes angiopathia kialakulásában,patomechanizmusában.1,2,10,19 Az általunk vizsgált gyors hatású analóg inzulinok in vitro gyorsítják a fibrinolysis kulcsfontosságú enzimatikus lépését, a tPA indukálta plazmingenerációt. A B28Asp inzulin hatása bizonyult rendszerünkben erőteljesebbnek, s ez az inzulinanalóg volt képes az in vitro alvadékoldódás statisztikailag jól értékelhető gyorsítására is. Eredményeink arra utalnak, hogy az analóg inzulinok (különösen az aspart inzulin esetében) valószínűleg fokozhatják a fibrinolysis cukorbetegségben általában lelassult folyamatát. Ez azonban olyan feltételezés, extrapoláció, melynek igazolására gondosan kivitelezett prospektív klinikai felmérések szükségesek. Külön figyelmet érdemel az, hogy a plazmingeneráció és az alvadékoldás fokozódása a relatíve alacsony inzulinkoncentrációk mellett következik be, amely vélhetően az inzulinanalóggal végzett kezelés során, az alkalmazott dózistól is függően, az injekciók adását követően inkább csak órák múlva jelenhet meg.19,20
Az epszilon-aminokapronsav (0,5 mM) mellett a plazmingeneráció ismert módon gyorsul. Az epszilon-aminokapronsav után adott inzulin B28 nem gyorsítja tovább a plazmingenerációt. A inzulin B28 után adott epszilon-aminokapronsavnak sincs további gyorsító hatása. Ez arra utal, hogy a két molekula azonos helyen fejtheti ki hatását a plazminogénre, azaz a plazminogén 4-es, ún. Kringle domainjén, mely a molekula fibrinkötő helye. Így a plazmingenerációt serkentő hatás mértékében és módjában is az élettani fibrin hatásra emlékeztet.11
A plazmingeneráció mérésével kapcsolatosan általában rendkívül csekély a klinikai tapasztalat, s az inzulinnak a plazminogén-plazmin átalakulást direkt módon befolyásoló hatásaival kapcsolatos közlések pedig nem ismeretesek. Indirekt módszer alapján Sakkinen és mtsai21 feltételezik, hogy inzulinrezisztenciában, hyperinsulinaemiában csökkenhet a plazmingeneráció és a fibrinolysis, s ez következményesen hozzájárul az erek betegségeinek kialakulásához. A hyperinsulinaemiát a legtöbb tanulmány a fibrinolysis gátlásával kapcsolja össze, a hatás nem direkt, hanem az inzulin, a proinzulin és a proinzulin-szerű molekulák PAI-1-szintézist fokozó hatásával magyarázzak.1,2,10 Vannak azonban olyan megfigyelések is, amelyek a cukorbetegek coronariaeseményeinél az intenzív inzulinterápia kapcsán a fibrinolysis gyorsulását, javulását dokumentálják.22 Hilal és mtsai23 IGF-1 in vitro hatásra osteoblastokban a plazmingeneráció urokináz indukálta gátlását észlelték.
Kérdés, hogy az analóg inzulinok in vitro haemostasis-hatása mennyire tükrözi a természetes monomer humán inzulin direkt in vitro fibrinolyticus tulajdonságait, azokat, amelyeket nem igazán tudunk a savas pH, oldószerek, polimerizáció okozta technikai nehézségek miatt vizsgálni. Valószínű az, hogy a kísérletek során kapott eredmények az aggregáció, plazmingeneráció, alvadékoldás kapcsán valójában rendkívül közel állhatnak az emberi inzulin élettani direkt haemostaticus hatásaihoz. Minden bizonnyal azért észlelhettünk erőteljesebb profibrinolyticus hatást a B28Asp inzulin (aspart, Insulin B28) esetében, mert annak aminosavszekvenciája (csak egy aminosav a különbség) és harmadlagos konformációja jobban hasonlít a humán inzulinéhoz, mint a Lispro analóg inzuliné.15
IRODALOM
1. Jude, B: Diabete et thrombose arterielle. Journ Annu Diabetol Hotel Dieu 95-105, 2000.
2. Meigs, JB, Mittleman, MA, Nathan, DM, Tofler, GH, Singer, DE, Murphy-Sheehy, PM, Lipinska, I, D`Agostino, RB, Wilson, PW: Hyperinsulinemia, hyperglycemia and impaired hemostasis, the Framingham Offspring Study. JAMA 283: 221-228, 2000.
3. Yudkin, JS: Abnormalities of coagulation and fibrinolysis in insulin resistance. Diabetes Care 22: 25-30, 1999.
4. Anfossi, G, Massucco, P, Mattiello, L Piretto,V, Mularoni, E, Cavalot, F, Paoletti, G, Trovati, M: Insulin exerts opposite effects on platelet function at physiological and supraphysiological concentrations. Thromb Res 82: 57-68, 1996.
5. Kahn, NN: Platelet-stimulated thrombin and PDGF are normalized by insulin and Ca2+ channel blockers. Am J Physiol 276: 856-862, 1999.
6. Li, Y, Woo, V, Bose, R: Platelet hyperactivity and abnormal calcium homeostasis in diabetes mellitus. Am J Physiol Heart Circ Physiol 280: 1480-1489, 2001.
7. Udvardy M, Pfliegler Gy, Rák K: Platelet membrane insulin receptor determination in non insulin dependent diabetes mellitus Experientia 41: 422-424, 1985.
8. Udvardy M, Hársfalvi J, Posán E, Rák K: Possible role for platelet insulin receptors to modulate platelet functions in health and diabetes mellitus, Platelets 4: 287-288, 1993.
9. Trovati, M, Massucco, P, Mattiello, L, Mularoni, E, Cavalot, F, Anfossi, G: Insulin increases guanosine-3',5'-cyclic monophosphate in human platelets. A mechanism involved in the insulin anti-aggregating effect. Diabetes 48: 1015-1019, 1994.
10. Festa, A, D`Agostino, R, Mykkanen, L, Tracy RP, Zaccaro, DJ, Hales, CN, Haffner, SM: Relative contribution of insulin and its precursors to fibrinogen and PAI-1 in a large population with different stages of glucose intoerance. The IRAS study. Arterioscler Thromb Vasc Biol 19: 562-568, 1999.
11. Mossesson, HW: The roles of fibrinogen and fibrin in hemostasis and thrombosis. Semin Hematol 29: 177-188, 1992.
12. Udvardy M, Posán, E, Hársfalvi, J: Altered lysis resistance of platelet-rich clots in patients with insulin-dependent diabetes mellitus. Thromb Res 79: 57-63, 1995.
13. Vajo, Z, Fawcett, J, Duckworth, WC: Recombinant DNA technology in the treatment of diabetes, insulin analogs. Endocr Rev 22: 706-717, 2001.
14. Editorial: Insulin aspart, B28, Insulin B28. Drugs 2: 103-106, 1999.
15. Betz, JL: Fast acting human insulin analogs, a promising innovation in diabetes care. Diabetes Educ 21: 195-198, 1995.
16. Bolli, GB, DiMarchi, RD, Park, GD, Pramming, S, Koivisto, VA: Insulin analogues and their potential in the management of diabetes mellitus. Diabetologia 42: 1151-1167, 1999.
17. Jones, AJS, Meunier, AM: A precise rapid microplate clot lysis assay. Methodology, kinetic modelling and measuring catalytic constants for plazminogén activation during fibrinolysis. Thromb Haemostas 64: 455-463, 1990.
18. Touyz, R, M, Schiffrin, EL: Blunted inhibition by insulin of agonist-stimulated calcium, pH and aggregatory responses in platelets from hypertensive patients. J Hypertens 12: 1255-1263, 1994.
19. Kaku, K, Matsuda, M, Urae, A, Irie, S: Pharmakokinetics of insulin aspart, a rapid acting analog of human insulin in healthy japanese volunteers. Diabetes Res Clin Pract 49: 119-126, 2000.
20. Home, PD, Barriocanal, L, Lindholm, A: Comparative pharmakokinetics and pharmacodynamics of the novel rapid-acting insulin analogue, insulin aspart in healthy volunteers. Eur J Clin Pharmacol 55: 199-203, 1999.
21. Sakkinen, PA, Cushman, M, Patsy, BM, Rodriguez, B, Boineau, R, Kuller, LH, Tracy, RP: Relationship of plasmin generation to cardiovascular disease risk factors in elderly man and woman. Arterioscler Thromb Vasc Biol 19: 499-504, 1999.
22. Melidonis, A, Stefanidis, A, Tournis, S, Manoussakis, S, Handanis, S, Zairis, M, Dadiotis, L, Foussas, S: The role of strict metabolic control by insulin infusion on fibrinolytic profile during an acute coronary event in diabetic patients. Clin Cardiol 23: 160-164, 2000.
23. Hilal, G, Martel-Pelletier, J, Pelletier, JP, Duval, N, Lajaunesse, D: Abnormal regulation of urokinase plasminogen activator by insulin like growth factor I in human osteoarthritic subchondral osteoblasts. Arthritis Rheum 42: 2112-2122, 1999.
- Közlésre érkezett: 2001. október 27.
- Közlésre elfogadva: 2002. április 12.
- A szerző levelezési címe: Dr. Udvardy Miklós
- Debreceni Egyetem OEC, II. Belgyógyászati Klinika
- 4012 Debrecen, Nagyerdei krt. 98.